 丁香医生审稿专业委员会同行评议通过
丁香医生审稿专业委员会同行评议通过简介
NGS 基因检测是什么?
基因,是一段储存着生命全部遗传信息的序列。基因序列主要遗传自父母,但不同细胞的基因也可能发生突变。人的生、老、病、死都与基因有关。
下一代基因检测(Next-generation sequencing,NGS)又称为「第二代测序」、高通量测序,是一种 DNA 测序技术。这里的「下一代」是相对第一代测序(即 Sanger测序)说的。
NGS 基因检测使用多个 DNA 小片段的并行测序来确定 DNA 序列。
这种高输出量、高解析度的技术使个体基因组测序的速度显着提高,并降低了同时进行大量基因的测序的成本。
NGS 基因检测现阶段被用于复杂疾病或罕见病的诊断、遗传病的筛查、恶性肿瘤的评估、感染诊断和健康人群的体检。
适应证
NGS 什么情况下需要做 ?
许多疾病与基因序列有关。简单地说,当为了指导诊疗,需要获取大量(10 个左右或更多)基因序列信息进行诊断或评估时,考虑进行 NGS 测序。
NGS 测序能够迅速进行大量基因的测序,但大量基因的测序费用昂贵,所以要谨慎权衡 NGS 测序的经济负担和可提供的信息。
有时候只需要测几个基因,完全可以用其他更廉价的基因检测手段。当可提供的信息对患者的评估与治疗可能有充分指导意义时,才应进行对大量基因的 NGS 测序。
如果临床评估的对象需要检测的基因数量只有一个或者几个,可以使用其他基因检测方式(如 PCR 技术,可以检测某个特定的目标基因是否存在)得出足够指导治疗的结论,那么一般就不适用于 NGS 测序。
NGS 能检查出来什么?
- 复杂疾病或罕见病的诊断
在对复杂疾病或罕见病的诊疗中,如果快速获取有关基因序列意义重大,那么 NGS 测序就是最好的方法。
许多复杂疾病或罕见病与基因序列有关。对于这一类疾病,医生依据症状和其他辅助检查,多数情况下可以有初步考虑的诊断。但临床情况多变复杂,要确诊需要基因检测。NGS 测序大大提高了诊断复杂疾病和罕见病的效率和准确性。
例如:
1. 疑似遗传性疾病的筛查
对于一些有家族史的家庭,特别是有明确的恶性肿瘤家族史的情况,对于疑似存在恶性肿瘤综合征的患者需要进行相关检查以明确诊断,以识别风险,指导预防和监测策略。如:
(1)对于有前列腺癌或胰腺癌家族史的个体;
(2)对于有遗传性乳腺癌和卵巢癌综合征风险的个体;
(3)对于有遗传性胃肠道癌症风险的个体;
(4)对于有家族性急性白血病综合征风险的个体;
(5)对于有遗传性骨髓衰竭综合征风险的个体。2. 恶性肿瘤的评估
对于恶性肿瘤,需要仔细评估 NGS 测序的成本与带来的信息。这里先要说的是「临床可行性」这一概念,临床可行性越高,对该基因进行 NGS 测序越有意义。
本文采用欧洲肿瘤学会(ESMO)制定的分子靶标临床可行性量表(也就是 ESCAT 量表)的评价结果。以下对恶性肿瘤的 NGS 测序进行分类讨论:
(1)晚期非小细胞肺癌:晚期非小细胞肺癌分为晚期非鳞状非小细胞肺癌和晚期肺鳞状细胞癌。
对于晚期非鳞状非小细胞肺癌,建议通过肿瘤组织(首选)或血浆样本来检测 EGFR、ALK、MET、BRAF、ROS1、NTRK、RET,并根据检测的结果进行符合抗肿瘤药物适应证的用药;对于晚期肺鳞状细胞癌,不建议进行常规的 NGS 测序。同时,不建议此类患者根据 NGS 测序采用超适应证用药。
如果选择参与进行临床试验或经济条件好,晚期非小细胞肺癌患者可以开展更多位点的 NGS 测序。
如果经济条件好,还可以选择对晚期非小细胞肺癌检测肿瘤突变负荷(TMB),这将相对以上的套餐增加 1 万元以上的费用,但需要注意临床指导意义可能有限。
需要注意,更多位点的 NGS 测序以及 TMB 检测并非必须要做,如果感觉有经济压力,只要做 EGFR、ALK、MET、BRAF、ROS1、NTRK、RET 几个基因的 NGS 测序即可。
(2)晚期前列腺癌:如果患者可以用得上 PARP 抑制剂(一类对肿瘤细胞有抑制作用的靶向药物),应至少对 BRCA 1/2 突变进行基因检测,也可考虑检测 PTEN 基因突变。只有在患者充分知情同意、考虑到患者总体获益的基础上,才可以谨慎地进行针对更多基因的 NGS 测序。
(3)晚期胆管癌:NGS测序可用于检测晚期胆管癌患者的 IDH1、FGFR2、微卫星高度不稳定(MSI-H)、NTRK 融合。
只有在患者充分知情同意、考虑到患者总体获益的基础上,才可以谨慎地进行针对更多基因的 NGS 测序。
(4)晚期卵巢癌:NGS 测序可用于卵巢癌患者检测 BRCA 1/2 体细胞突变。只有在患者充分知情同意、考虑到患者总体获益的基础上,才可以谨慎地进行针对更多基因的 NGS 测序。
(5)检测肿瘤突变负荷(TMB):指每百万碱基中被检测出的,体细胞基因编码错误、碱基替换、基因插入或缺失错误的总数。
TMB 检查有助于判断免疫治疗的效果。TMB 检测不是针对单一基因,而是需要做大量基因的基因检测,因此价格昂贵,一般在 1.5 万元以上。以下分类讨论。
① 对于宫颈癌、未获得药物治疗的子宫内膜癌、外阴癌、唾液腺癌、甲状腺癌、小细胞肺癌、高分化或中等分化的神经内分泌肿瘤,如果之前先进行过的免疫组化中患者抗 PD-1 抗体阴性,则有指南认为可使用 NGS 测序检测肿瘤突变负荷(TMB),但尚有争议。目前的研究显示,在上述几种恶性肿瘤中, TMB 高的患者免疫治疗效果较好。
② 除了上述恶性肿瘤,肿瘤突变负荷在黑色素瘤、非小细胞肺癌和出现转移的头颈部恶性肿瘤中,也对患者的预后有提示作用,但临床指导意义可能有限。也就是说,在黑色素瘤、非小细胞肺癌和出现转移的头颈部恶性肿瘤患者中,TMB 检测并非必须要做。
③ 由于缺乏足够的临床意义,目前不推荐食管癌、胃癌、结直肠癌、尿路上皮癌、脑恶性肿瘤患者检查 TMB ,除非参与临床试验,无需自费的情况下。
(6)存在 NTRK 融合的患者可以使用 TRK 抑制剂(针对 NTRK 融合的靶向药物)
但是,我国大陆地区目前暂时没有获批上市的 TRK 抑制剂,香港有上市的药品,价格昂贵;仅有 <1% 的恶性肿瘤中存在 NTRK 融合阳性;可以使用更便宜的其他基因检测方式检测 NTRK 融合。因此,除前文有推荐进行NGS测序的肿瘤种类外,不常规推荐使用NGS测序检测 NTRK 融合。
(7)肿瘤会转移:有时候,医生观察到患者在多个器官存在肿瘤病灶,但并不知道恶性肿瘤最开始是哪个器官长出来的,哪个是肿瘤后续转移的。这时候,可以使用 NGS 测序确定原发恶性肿瘤。
(8)转移性结肠癌:一般不需要进行 NGS 检测,所需的基因检测可以通过 PCR 确定。在患者不必支付额外费用或患者有强烈意愿的条件下,可以考虑进行 NGS 测序,并检测 ERBB2、NTRK、MSI 的更多信息。
(9)晚期胰腺导管癌:一般不需要进行 NGS 检测。考虑到晚期胰腺导管癌的医疗需求和存在大量临床可行性不高的突变,研究中心可在充分保障患者方知情同意权的条件下,向患者方提出进行 NGS 测序,以便患者获得尚在临床试验中的新药。如果不进行 NGS 测序,MSI 和 NTRK 融合可以使用廉价的方式测定。
(10)晚期肝细胞癌:一般不需要进行 NGS 检测。考虑到晚期肝细胞癌的医疗需求和存在临床可行性不高的突变,研究中心可以在充分保障患者方知情同意权的条件下,向患者方提出进行 NGS 测序,以便患者获得尚在临床试验中的新药。如果不进行 NGS 测序,MSI 和 NTRK 融合可以使用廉价的方式测定。
(11)转移性乳腺癌:一般不需要使用 NGS 检测,诊疗所需的基因信息通过免疫组化和常规的 PCR 即可获取。转移性乳腺癌的患者一般无需为 NGS 检测付出更多费用。
(12)转移性胃癌:胃癌的检测首选通过传统的免疫组化、原位杂交(ISH)、PCR 等方式。但这些方式有时可能由于活检的样本有限或无法取传统的组织活检而难以实施。这时可以使用 NGS 测序的方式,对胃癌样本进行基因检测。
样本方面,首选取胃癌的组织活检进行 NGS 测序准确。对于转移性胃癌患者,胃癌细胞可能由肿瘤组织上「掉落」进入血液。因此,当转移性胃癌患者的情况不允许取胃癌组织进行活检时,可以考虑使用血液样本进行 NGS 测序,以了解胃癌的基因情况。但是,这样的血液检测结果不够准确,所以必须谨慎解读。
(13)对于正在进行一线治疗的非血液系统恶性肿瘤患者
如果有标准治疗方案,那么除晚期非鳞状非小细胞肺癌、晚期前列腺癌、晚期胆管癌、晚期卵巢癌外,不需要进行 NGS 测序,只需要通过 PCR 进行检测即可。对于可选治疗方案少或指南鼓励临床试验的患者,NGS 测序可能有帮助。
(14)对于血液系统的肿瘤:如白血病、淋巴瘤、多发性骨髓瘤等,涉及基因众多,而且互相之间往往差异明显,情况高度复杂。不仅是个体之间存在差异,即使是同一个体的不同肿瘤细胞之间也存在差异。在血液系统恶性肿瘤的进展过程中,也会发生基因突变情况本身的改变,如新的基因突变或原有的基因突变丢失。在这样复杂的基因改变面前,NGS 测序在传统的 PCR 或第一代测序面前有着显著优势。
因此血液肿瘤患者可以根据具体情况,在医生的指导下,采取包括 NGS 测序在内的基因检测手段。
(15)作为患者,需要认真考量 NGS 测序的必要性
而如果选择了 NGS 测序,也需要认真对待测序的基因数量(套餐大小)与成本的平衡问题。在经济条件不好的情况下,能够用其他基因检测方式达到的效果,就不必使用昂贵的 NGS测序;可以用小「套餐」达到的效果,就没必要做大「套餐」。
- 感染诊断
不常规对感染患者进行 NGS 测序,但遇到疑难情况时可能需要进行 NGS 测序。
感染,由细菌、病毒、真菌、寄生虫等生物导致,这些生物被称为「病原生物」。不同病原生物有着不同的应对方式。对于感染来说,明确是什么病原生物导致的、了解哪些药物对病原生物有效,往往很重要。
我们有常规的检验方法去了解究竟是什么病原生物导致的感染。包括:
(1)分离培养
先取样本进行分离培养,然后通过形态特征和相关生化反应的结果,判断具体病原生物、进行药物敏感试验。但是,这样的分离培养往往耗时巨大,并且漏测的风险相对高。此外,病毒以及细菌中的某些种类几乎无法进行分离培养。
(2)免疫试剂
速度快,检验科 1 小时内即可出结果。但是往往需要等感染后一段时间才能通过免疫试剂得出结论。此外,免疫试剂本身的准确性也不高。
(3)PCR 核酸检测
准确性高,24 小时内即可出结果,如果加急仅需 4 小时。PCR 原理的核酸检测在新冠疫情中被广泛使用。但是,PCR 核酸检测只能验证是否为已知的病原生物感染。如果并没有病原生物的明确的「嫌疑人」,那么 PCR 核酸检测就需要耗费大量时间一个一个测过去。
以上这三类方法比 NGS 测序要便宜。因此,不建议常规对感染患者进行 NGS 测序。
但常规检验方法有着自己的局限性。当常规检验方法无法得出结论,NGS 测序能更快获得有利的信息时,就应当考虑对感染的病原体进行 NGS 测序。
- 健康人群
目前没有充分证据支持在健康人群中进行 NGS 测序有益。有机构向健康人群开放 NGS 测序,在充分知情同意的前提下,确实有个人意愿、经济宽裕且机构能保护隐私,可以进行 NGS 测序。
禁忌证
NGS在哪些情况下不能做?
- NGS 测序本身无禁忌证
但并非所有人群都适合使用昂贵的 NGS 测序。如果用更加便宜的基因检测手段也能达到对相同或相近的诊疗意义,或由于样本的原因 NGS 测序没有指导意义或指导意义极为有限,就必须认真考虑使用是否有必要进行 NGS 测序,特别是要保障患者知情同意权。
- 伦理层面
未经本人充分知情同意的 NGS 测序不能做。NGS 测序由于价格昂贵,患者方需要了解以下问题:
(1)对于患者的情况,是否有指南推荐进行NGS测序?
(2)通过NGS测序获得的信息对诊疗有多大的重要性?
(3)如果选择对更少的基因进行测序,对诊疗有什么不利影响?注意事项
NGS 检测前要做什么准备工作吗?
NGS 测序前,患者方要充分地知情同意,包括价格、必要性和隐私保护事项。同时,要注意保存好有关医疗文书。
如果是通过手术或有创活检获取 NGS 测序所需要的组织标本,那么需要遵循手术或有创活检的有关注意事项,包括禁食时间、饮食内容、运动和用药。如果正在服药,那么需要咨询医生是否需要停药,并严格遵守。
NGS 测序未纳入医保。NGS 检测是通过什么方式进行的?NGS 检测是要抽血吗?
NGS测序使用相应的样本进行。医生在获取标本后,会将标本经妥善处理,送往在本院或院外检测机构进行NGS测序。
NGS测序的标本有如下几种类型:
(1)手术和活检后的新鲜冷冻组织:对于实体恶性肿瘤的 NGS 测序,首选的样本是手术和活检后的新鲜冷冻组织。新鲜组织可以在从体内去除后 30 分钟内储存在液氮或 -80℃ 的冰箱中,以防止核酸的降解。
(2)福尔马林固定石蜡包埋(FFPE)组织:这一类标本用于长期保存供将来使用。
(3)细胞学样本:包括胸水、腹水、脑脊液中的细胞学样本。对于恶性肿瘤来说,在进行 NGS 检测前,必须确认胸水和腹水样本中存在肿瘤细胞。
(4)血浆或血液:进行 NGS 测序时,至少采血 8 毫升。血浆或血液中,肿瘤来源的 DNA的比例在不同类型和阶段的癌症中有显著差异。
对于非血液系统的恶性肿瘤,使用血浆或血液作为标本进行 NGS 测序,参考价值低于手术和活检后的新鲜冷冻组织的。
做NGS 检测时,需要注意什么?
取决于获取标本的途径。通过手术、活检或抽取胸水、腹水、脑脊液获取标本时,需要严格遵守该操作前的医嘱。比如,医生说术前某一时间段开始要禁食、某一时间段开始要禁水,那么就要听医生的。这方面如果有异议或疑问,也要及时提出,不可自作主张。
做 NGS 检测要花多久时间?
取决于获取标本的途径。手术可能持续较长时间;取各类活检、抽取胸水、抽取腹水、腰椎穿刺取脑脊液的时间一般需要数分钟到半小时;如果是抽取血液样本,需要 2 分钟左右。
做完 NGS检测后,需要注意什么?
无特别注意事项,具体取决于获取标本的途径,获取标本后需要严格遵守医嘱。
并发症
NGS 检测时,哪些情况可能会导致结果异常?
- 不同部位本身存在异质性,而所取得的组织样品不可能覆盖整个病灶,因此可能导致检测结果一定程度上缺乏代表性;
- 样本被污染,如实验操作中未清除其他样本、不同患者之间未更换一次性耗材、异种基因组污染(主要发生于石蜡包埋组织);
- 物流运输上存在问题,导致样本没有在合适的温度下被储存、运输;
- 如果是血液样本,样本发生溶血会导致血细胞中释放出大量本不在血浆中的DNA,显著影响 ctDNA 的浓度;
- FFPE 制备及长期保存导致的基因组受损;
- 样品丢失或误用他人样品;
- 新鲜冷冻组织样品肿瘤含量不足<20% ,导致检测结果偏差,特别是肿瘤细胞含量<10% 时,会显著影响检测结果;
- 不同仪器、不同检测与分析方法、不同技术人员的质量控制问题可能导致不同检测机构出现有出入的结果。
结果解读
NGS 检测报告要关注哪些结果?
一份 NGS 测序报告包括 4 大部分:基本信息、报告小结、各检测项目具体结果以及质量控制报告。
重点关注检测项目的具体结果,其余部分也需要了解。
以下使用样表,对 NGS 测序结果进行解释。
(1)基本信息

一份 NGS 报告,最前方即为基本信息,那到手后需要核对这些信息是否属于患者本人本次检验的结果。(2)报告小结
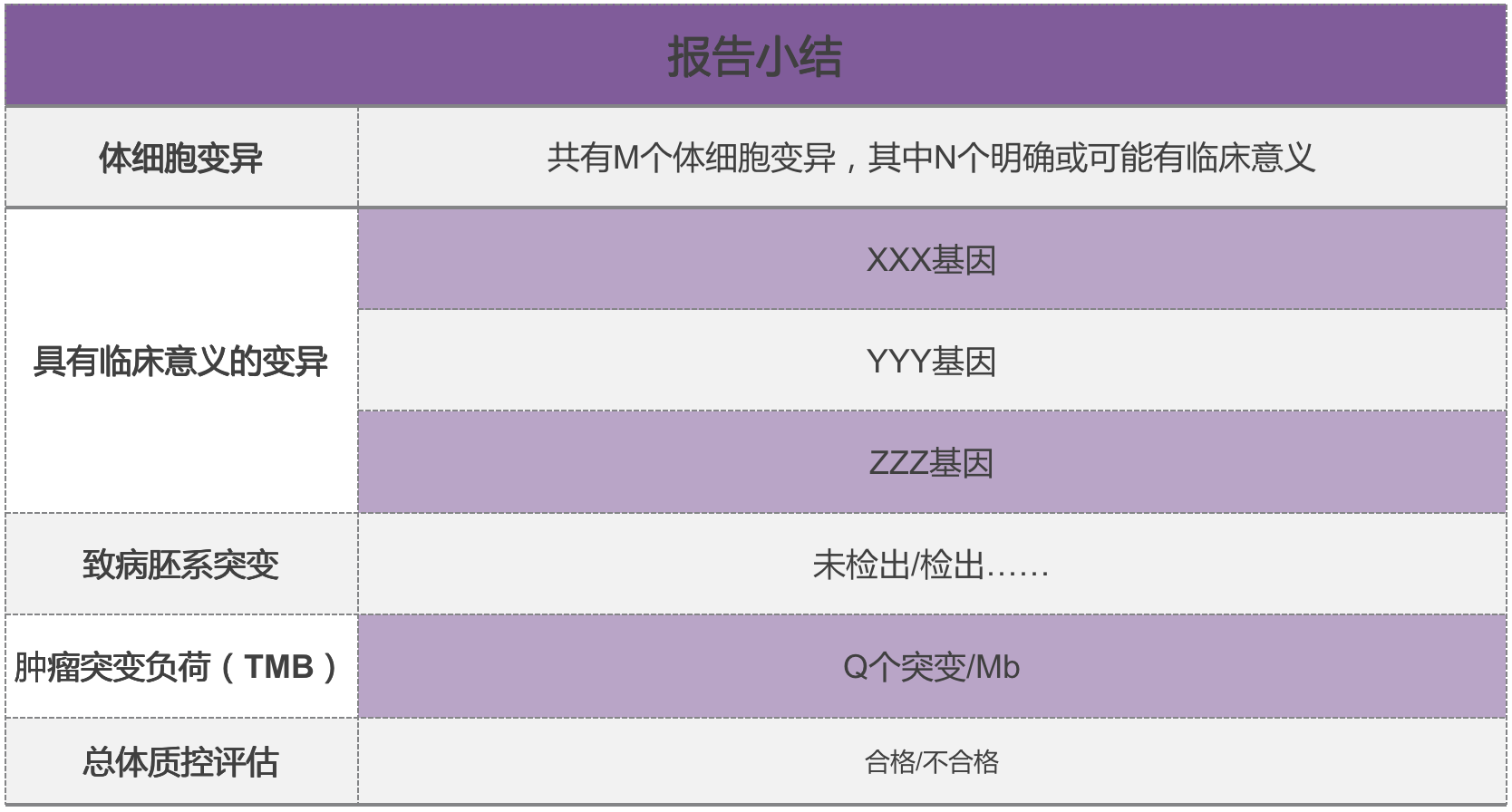
报告小结为整个 NGS 测序核心内容的概括性体现。其中:
① 有临床意义的变异:即可以作为依据进行相应临床诊疗决策的基因突变。肿瘤治疗中,可以据此选择治疗方案。
② 胚系突变:指人在胚胎发育时就已经存在的基因突变,通常来自父母,与疾病的遗传风险有关。
③ 肿瘤突变负荷(TMB):评价基因突变频率高低。肿瘤突变负荷高,可能意味着免疫治疗疗效相对好。
④ 总体质控评估:结果为合格或不合格。质控合格意味着经检测机构的质控检查,一份 NGS报告质量合格。NGS 检测报告中体系变异是什么?
体系变异,相对于胚系突变而言,是指肿瘤组织细胞本身发生的变异。胚系突变的检测样本一般取材于人体正常细胞,比如血样、口腔粘膜细胞。而体系突变检测的材料,就是肿瘤组织本身,一般来自于外科手术切除或者穿刺活检。
除非合并有胚系突变,单独的体系变异不会由父母遗传给子女。体系突变,更多的情况下与癌症患者本身肿瘤生物学行为、抗肿瘤靶向或免疫治疗方案选择、抗肿瘤治疗预后密切相关。
NGS 检测报告中有临床意义的变异结果如何解读?
结果参考样式如图:

具有临床意义的变异,指的是可以作为依据进行相应临床诊疗决策的基因突变。事实上,基因突变根据其临床意义的高低,分为 4 大类;而在提这 4 大类之前,我们先要明确一个概念,即「证据等级」。
① 证据等级:临床上将根据基因检测结果的用药根据证据分为 4 个级别:
A 级:中国国家药监局(CFDA)或美国食品药品监督管理局(FDA)批准的用药或专业指南推荐的用药;
B 级:经过高质量的临床研究证实,并且获得该领域专家共识的用药;
C 级:中国国家药监局(CFDA)或美国食品药品监督管理局(FDA)在其他癌症种类上批准过的疗法或在研疗法;或者多项已经发表的小型研究,获得了部分专家的共识;
D 级:还未进入临床研究,只做了进入临床之前的研究;或者只有少量个案报道,没有专家共识。我们把拥有 A 级或者 B 级用药证据的突变称为「I 类变异」,而有 C 或 D 级用药证据的突变称为「II 类变异」,二者合称「有临床意义的变异」。
III 类变异临床意义不明,IV 类变异则指无害或没有已经发表的有害证据的变异。
② 丰度:即为突变丰度,可以简单理解为突变基因在肿瘤细胞中的占比。一个基因突变的丰度越高,肿瘤组织中含有这种突变基因的细胞比例越大。
③ 潜在获益药物:靶向药物针对突变的基因作为靶点。因此,根据突变的基因,存在针对性的靶向药物可供使用。患者需要结合自身情况,与医生充分沟通,遵医嘱使用靶向药物。
NGS 检测报告中突变丰度结果如何解读?
突变丰度是指在某个基因位点上,在所有可能出现的基因中,某突变基因所占的比例。
突变丰度的解读:
- 突变丰度的数值变化可用于观察疗效,反映疾病的动态变化。
- 突变丰度可能与靶向药物的疗效相关,比如,丰度更高可能具有更好的疗效,或用药后短期内丰度迅速下降,可能提示对药物响应佳。
- 对于某些耐药突变,如 T790M,丰度增加可能提示出现获得性耐药。
目前对突变丰度的研究较局限,仍仅仅集中于对部分突变的研究,如 EGFR 突变。并且目前对于基因检测的丰度判断尚没有统一的标准。
丰度会受测序方法、检测公司、每次取样标本所含肿瘤细胞量等因素的影响而波动。
NGS 检测报告中胚系突变结果如何解读?
结果参考样式如图:
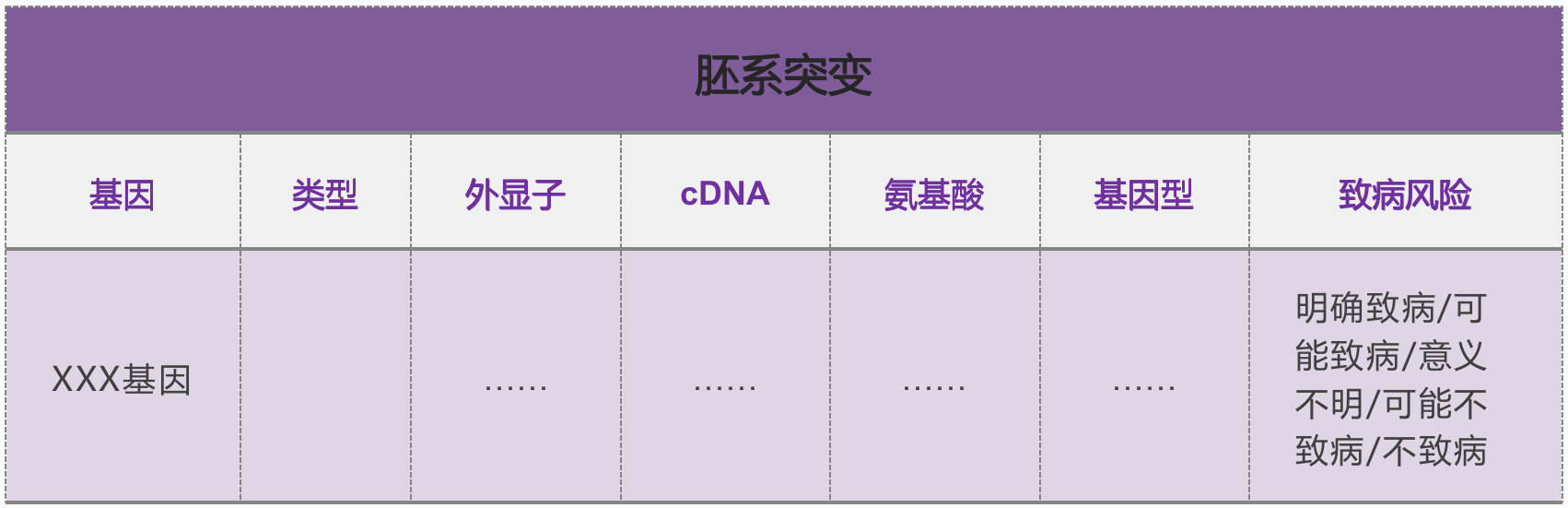
胚系突变指人在胚胎发育时就已经存在的基因突变,通常来自父母,分为「致病、可能致病、意义不明、可能不致病、不致病」 5 个级别。
胚系突变与疾病的遗传风险有关,存在胚系突变意味着很可能遗传给下一代。
NGS 检测报告中肿瘤突变负荷(TMB)结果如何解读?
结果参考样式如图:
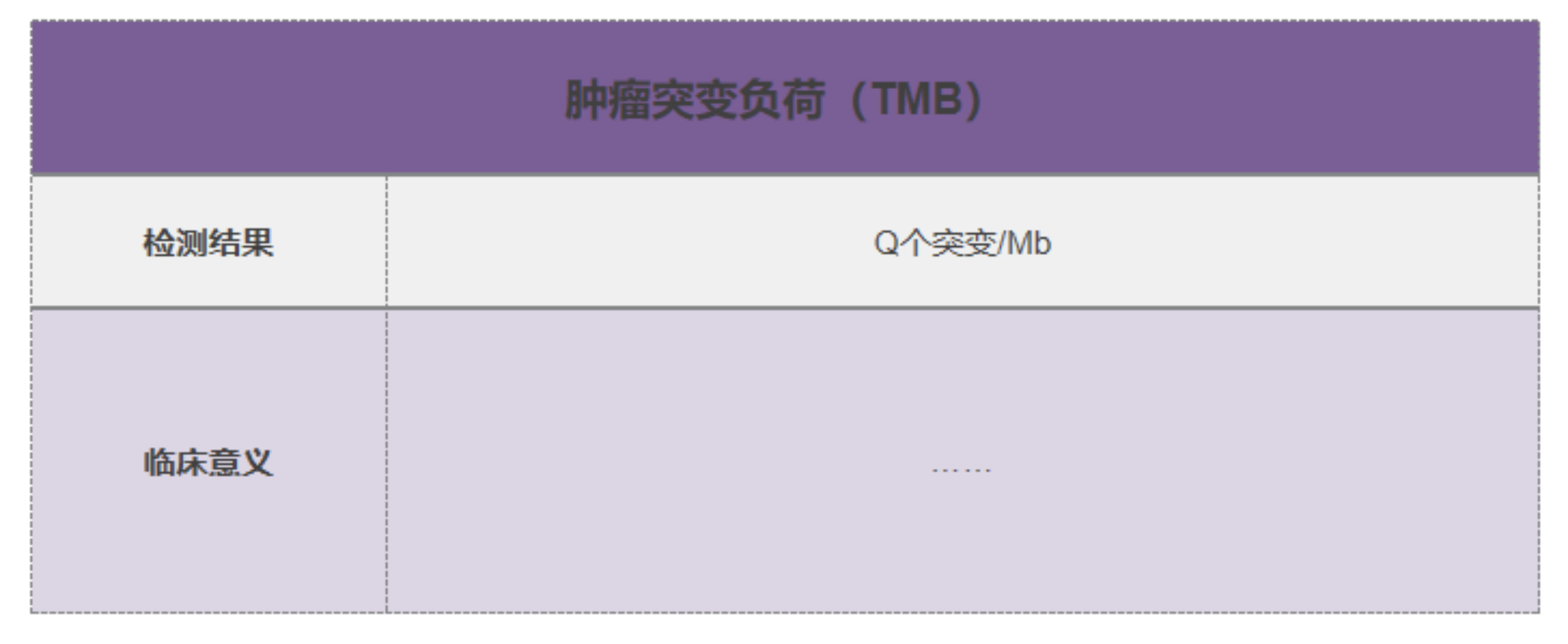
肿瘤突变负荷(TMB)是评价基因突变频率高低的指标。
肿瘤突变负荷高,可能意味着免疫治疗疗效相对好。但是,肿瘤突变负荷低的情况,并不一定意味着免疫治疗药物无效。这时是否使用免疫治疗药物,需要综合考虑肿瘤具体情况、患者经济条件、患者主观意愿、获益的机会和用药风险。
NGS 检测报告中微卫星不稳定性(MSI)结果如何解读?
结果参考样式如图:

微卫星不稳定性(MSI)对于多种肿瘤的评估和治疗方案的制订具有重要意义,但在不同肿瘤患者中的意义存在不同,因此这里不做展开介绍。具体解读请咨询医生。
通常情况下,通过免疫组化和 PCR 核酸检测,即可获知微卫星不稳定性(MSI),无需为此专门进行 NGS 测序。
NGS 检测报告用于复杂疾病、罕见病或遗传性疾病的结果如何解读?
相对肿瘤的 NGS 测序,复杂疾病、罕见病或遗传性疾病的 NGS 报告,最重要的信息是对具体疾病种类的诊断信息,关注结论性语言即可。
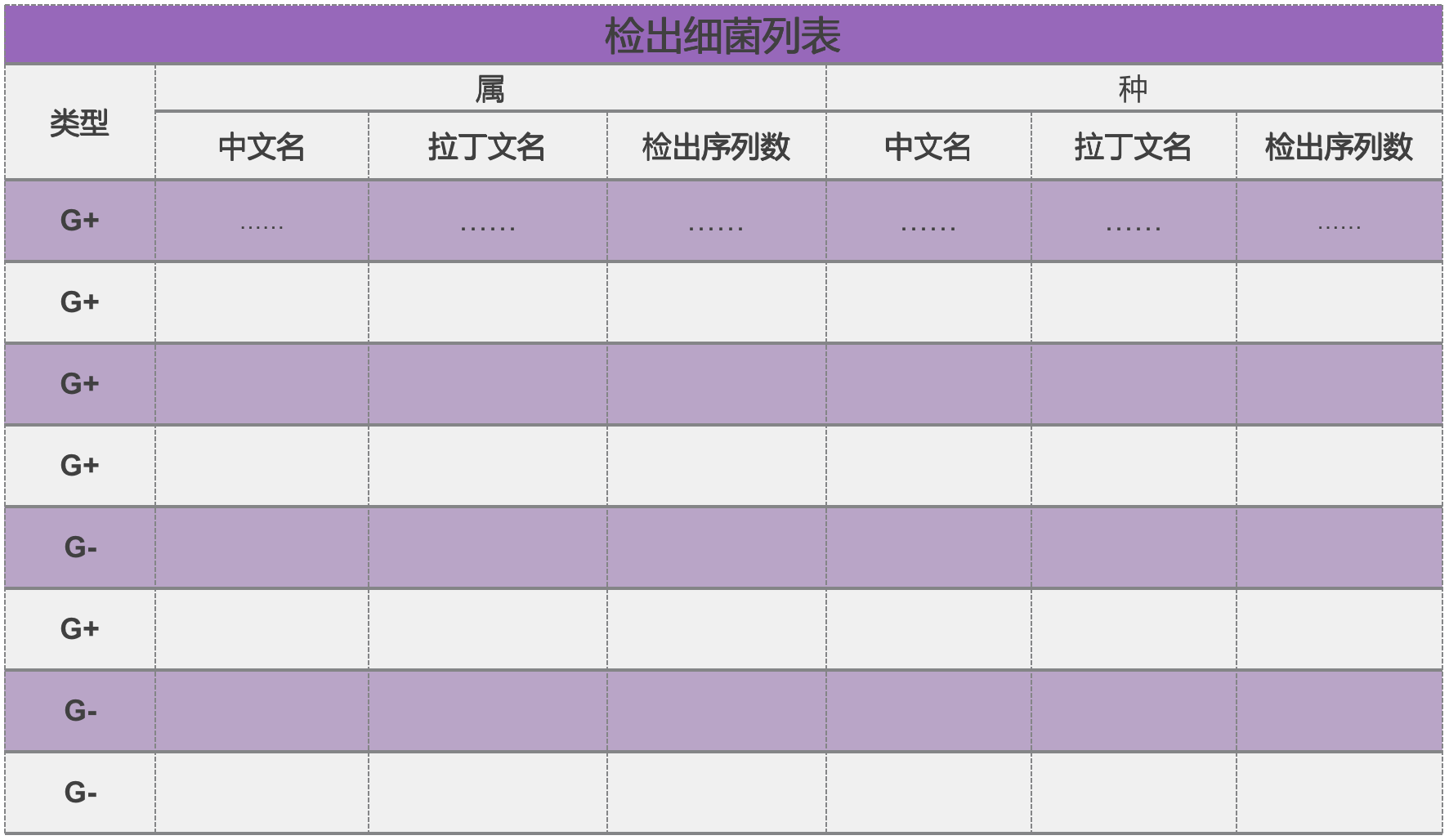
NGS 检测报告中用于感染诊断的结果如何解读?
用于感染诊断的 NGS 测序报告最重要的信息是对具体病原体种类的鉴定信息,参考如图:
同一个样本中,往往存在多种不同的病原生物。检出序列数越多,意味着该病原生物在样本中数量越多。
但要注意的是,检出的各种病原生物不一定都是真正致病的病原生物;检出序列数高的病原生物,也不一定意味着其就是真正致病的「罪魁祸首」。这些数据需要由专业人士进行解读。
此外,NGS 测序还能在耐药性方面提供参考,从而使用最可能对该病原生物有效的药物。具体用药需要遵医嘱。质控方面的结果参考肿瘤的 NGS 测序。
NGS 检测报告是否能用于健康人群?结果该如何解读?
目前没有充分证据支持在健康人群中进行 NGS 测序有益,健康人群的 NGS 测序报告结果需要在医生指导下谨慎解读。质控方面的结果参考肿瘤的 NGS 测序。
NGS 检测报告中质量控制报告如何解读?
结果参考样式如图:
该页是关于 NGS 测序本身质量是否合格的评估结果。
普通人需要关注三点:
- NGS 测序报告是否有质量控制这一页;
- 「数值」一栏里的数据是否都在「质控标准」的范围以内;
- 总体质控评估是否合格。
NGS 检测报告大概需要多久可以拿到?
多数情况下,2~5 周可以拿到结果;如果涉及更复杂的病例,需要的时间可能更长。
具体以检测机构和医生说明为准。
更多信息
NGS 检测准确性如何?
全基因组和外显体测序的 NGS 序列可以得到超过 92% 到 95% 的可用数据。
只要采样符合标准、送检后整个流程严格符合质量控制规范,那么 NGS 测序的结果在多数情况下是准确的。
NGS 检测可以在门诊进行吗?
大多数的 NGS 测序取样是在住院期间进行的。如果需要手术,则需要住院或者接受日间手术管理;取各类活检可能可以在门诊进行,但多数是在住院期间进行评估;抽取胸水、抽取腹水、腰椎穿刺取脑脊液、抽取血液样本可以在门诊进行。
NGS 检测应该去哪个科室?
取决于具体问题归属的科室:
- 实体恶性肿瘤的 NGS 测序建议在肿瘤内科医生的建议和评估下进行;
- 血液病的 NGS 测序在血液科医生的建议和评估下进行;
- 新生儿和儿童的复杂疾病、罕见病或遗传性疾病的 NGS 测序,建议在新生儿科或儿科医生的建议和评估下进行;
- 成人复杂疾病、罕见病或遗传性疾病的 NGS 测序在相应科室进行,如风湿免疫科、内分泌科等;
- 用于感染诊断的 NGS 测序,一般在感染科或重症医学科医生的建议和评估下进行;
- 健康人群的 NGS 测序,可咨询医院的体检中心。
NGS 检测大概需要多少钱?
取决于检测基因的数量和类型:
- 10 个基因左右的 NGS 测序套餐通常需要 5000~8000 元;
- 200 个靶点左右的 NGS 测序套餐通常需要 2~3 万元;
- 全外显子测序、全基因组测序价格更加昂贵。
NGS 测序,目前不能用医保。
拿到 NGS 检测结果 ,需要注意什么?
作为患者,需要妥善保管 NGS 检测报告,基因信息是人最重要的信息之一。
NGS 测序报告的结果需要谨慎解读,出结果后一定要认真听医生解释,并沟通下一步的诊疗计划。
如果有条件,可以寻求更多医生的建议,如网络咨询。
NGS 对比起其他基因检测,有什么区别?
NGS测序的优势:
- 通量大,可以用少量样本一次检测大量基因,对于大量基因的测序来说速度显著提高;
- 在进行大量基因测序时,提高了对于单个基因的性价比,相对第一代测序法降低了同时进行大量测序的成本;
- 直接测定核酸序列,在肿瘤评估、遗传性疾病、复杂疾病或罕见病和感染诊断上能为临床提供准确的依据;
- 即使突变丰度较低,也相对其他基因检测途径更容易检测到。
NGS测序劣势:
- PCR 核酸检测最快可以在 4~6 小时内出结果,对于少量基因的检测比 NGS 测序快,新冠核酸检测即主要采取基于 PCR 的技术;
- 进行大量基因的测序,本身成本较高;
- 部分技术存在困难,例如,对于融合突变,NGS-DNA 测序假阴性发生率较高,而更加可靠的 NGS-RNA 测序对样本的质量要求高。
- 对于具体一个基因来说,第一代测序准确性可以达到 99.99% ,高于 NGS 测序。
- NGS 测序医保目前不报销。
参考资料[1]Peter J Hulick.Next-generation DNA sequencing (NGS): Principles and clinical applications. UpToDate 临床顾问. https://www.uptodate.com/contents/next-generation-dna-sequencing-ngs-principles-and-clinical-applications .(Accessed on Aug 21, 2020)
[2]Adams, David, R, et al. Next-Generation Sequencing to Diagnose Suspected Genetic Disorders[J]. New England Journal of Medicine, 2018.
[3]Mosele F , Remon J , Mateo J , et al. Recommendations for the use of next-generation sequencing (NGS) for patients with metastatic cancers: a report from the ESMO Precision Medicine Working Group - ScienceDirect[J]. Annals of Oncology, 2020.
[4]Rousseau B, Foote MB, Maron SB, et al. The Spectrum of Benefit from Checkpoint Blockade in Hypermutated Tumors. [J]. New England Journal of Medicine, 2021.
[5]Application of next-generation sequencing technology to precision medicine in cancer: joint consensus of the Tumor Biomarker Committee of the Chinese Society of Clinical Oncology[J]. Cancer Biology and Medicine, 2019, 016(001):P.189-204.
[6] National Comprehensive Cancer Network . NCCN Guidelines Version 2.2022 - Gastric Cancer[EB/OL]. 2022[2022-3-01].https://www.nccn.org/guidelines/guidelines-detail
Update:2022.03
发布时间 2021年07月27日
最后修订时间 2023年08月17日
· 用于筛查罕见病遗传病,评估恶性肿瘤等。
· 不适用只检测一个或几个基因。


